CARDIOPATIAS

Livreto: CARDIOPATIAS
Reunimos neste livreto informações essenciais de dezenas de cardiopatias e os testes genéticos atualmente aplicados.
Baixe aqui o arquivo PDF.
CARDIOMIOPATIAS
ARRITIMIAS
AORTOPATIAS
DISLIPDEMIAS
RASOPATIAS
Cardiomiopatia Hipertrófica (CMH)
CMH é uma cardiopatia hereditária caracterizada pela hipertrofia do ventrículo esquerdo não explicada por outras condições (doenças metabólicas, hipertrofias secundárias, treinamento físico, hipertensão arterial ou valvopatias).
CRITÉRIOS DIAGNÓSTICOS

Ecocardiograma transtorácico (ECOTT) e Ressonância Magnética Cardíaca (RMC) com espessura (Qualquer critério positivo):
● ≥ 15 mm no VE na ausência de causa secundária que justifique o achado.
● ≥ 13-14 mm no VE E familiar com CMH ou teste genético positivo.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de CMH.
● Familiar de primeiro grau, após estudo genético do probando.
● Pacientes com formas atípicas de apresentação clínica com suspeita de fenocópia.
Rendimento do teste genético é 60%

PRINCIPAIS GENES RELACIONADOS
| MYH7 | ACTC1 |
| MYBPC3 | TNNT2 |
| TNNI3 | CSRP3 |
| TPM1 | TNNC1 |
| MYL2 | JPH2 |
| MYL3 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Detectar possíveis fenocópias que podem ter tratamento específico como terapia de reposição enzimática na Doença de Fabry, ou necessitar de um seguimento clínico individualizado como na Doença de Danon, ou sinalizar maior gravidade e risco de arritmias e bloqueios atrioventriculares como na Síndrome de PRKG2.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Ommen SR, et al. 2020. Circulation.
2020;142:e558–e631.
3. Clinical Genome Resource
https://clinicalgenome.org
Cardiomiopatia Dilatada (CMD)
CMD é uma cardiopatia hereditária caracterizada pela dilatação do ventrículo esquerdo
ou biventricular com consequente disfunção sistólica na ausência de alterações de
sobrecarga (HAS, valvopatias) ou doença coronariana.
CRITÉRIOS DIAGNÓSTICOS
Todos os critérios são obrigatórios:
● Dilatação das câmaras cardíacas: Ecocardiograma transtorácico (ECOTT) e
Ressonância Magnética Cardíaca (RMC) com DDVE ≥ 58mm em homens e
≥ 52mm em mulheres.
● Disfunção ventricular: FEVE < 45% OU fração de encurtamento < 25%.
● Exclusão de outras causas: prova isquêmica negativa (se >40 anos),
sorologia chagas negativa, ausência de valvopatias importantes (exceto
insuficiência mitral secundária) E ausência de outras causas prováveis
(etilismo).
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de CMD e um dos demais:
○ História familiar de CMD ou de Morte Súbita Cardíaca (MSC).
○ Características clínicas sugestivas de doença genética como:
doença do sistema de condução (BAV, DNS) em idade precoce,
elevação de CPK, arritmias ventriculares (TVS, FV).
○ CMD em < 60 anos mesmo sem história familiar e excluídas causas
secundárias.
● Familiar de primeiro grau, após estudo genético probando.
Rendimento do teste genético é 20-50%
(dependente do contexto familiar)

PRINCIPAIS GENES RELACIONADOS
| BAG3 | SCN5A | JPH2 |
| DES | TNNC1 | NEXN |
| FLNC | TNNT2 | TNNI3 |
| LMNA | TTN | TPM1 |
| MYH7 | DSP | VCL |
| PLN | ACTC1 | |
| RBM20 | ACTN2 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Detectar possíveis genótipos com implicações prognósticas, por exemplo LMNA, FLNC, DES, PLN e RBM20; ou que possam modificar o manejo clínico, como avaliação especializada para doenças neuromusculares, doenças mitocondriais e síndromes congênitas.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Peters S, et al. 2019.
doi: 10.1016/j.hlc.2019.11.018.
3. Clinical Genome Resource
https://clinicalgenome.org.
4. Marcondes-Braga FG, et al. 2021.
Arq Bras Cardiol. 116(6):1174-1212.
Cardiomiopatia Arritmogênica (CMA)
CMA é caracterizada por substituição fibrogordurosa progressiva com consequentes
alterações regionais e globais nos ventrículos e alta carga de arritmias ventriculares.
CARDIOMIOPATIA ARRITMOGÊNICA (CMA). Pode levar aos seguintes fenótipos: forma dominante direita (clássica CAVD – de Ventrículo Direito), forma biventricular e forma dominante esquerda.
CRITÉRIOS DIAGNÓSTICOS

Todos os critérios são obrigatórios:
● Dilatação das câmaras cardíacas: Ecocardiograma transtorácico (ECOTT) e
Ressonância Magnética Cardíaca (RMC) com DDVE ≥ 58mm em homens e
≥ 52mm em mulheres.
● Disfunção ventricular: FEVE < 45% OU fração de encurtamento < 25%.
● Exclusão de outras causas: prova isquêmica negativa (se >40 anos),
sorologia chagas negativa, ausência de valvopatias importantes (exceto
insuficiência mitral secundária) E ausência de outras causas prováveis
(etilismo).
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de CMA
Rendimento do teste genético é 50-60%

PRINCIPAIS GENES RELACIONADOS
| PKP2 | PLN | |
| DSG2 | FLNC | |
| DSC2 | DES | |
| DSP | LMNA | |
| JUP | CDH2 | |
| TMEM43 | RYR2 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Detectar possíveis genótipos com implicações prognósticas e terapêuticas, por exemplo FLNC, DSP, LMNA, DES, TMEM43 e PLN.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Marcus FI, et al. 2010.
doi: 10.1093/eurheartj/ehq025
3. Corrado D, et al. 2020.
doi: 10.1016/j.ijcard.2020.06.005
4. Clinical Genome Resource
https://clinicalgenome.org.
5. Marcondes-Braga FG, et al. 2021.
Arq Bras Cardiol. 116(6):1174-1212.
6. SOBRAC - Hachul DT, et al. 1a ed.
São Paulo: Atheneu, 2020.
Cardiomiopatia Não-Compactada (CMNC)
Cardiomiopatia não-compactada apresenta-se com aumento das trabeculações
ventriculares podendo estar relacionada à disfunção ventricular, ou ocorrer associadas
à outras síndromes clínicas como doença neuromuscular, distúrbios de condução
ventricular, CMD e CMH.
CRITÉRIOS DIAGNÓSTICOS
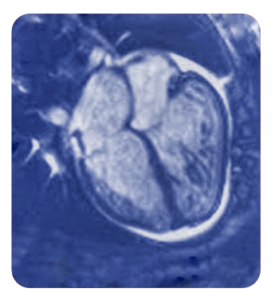
● Ressonância magnética cardíaca (RMC) com proporção miocárdio não-compactado / compactado > 2,3 na diástole.
● Exclusão: atletas, gravidez, achado incidental de não-compactação sem contexto clínico.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de CMNC (baseado em história clínica, exame físico, ECG, ECOTT/RMC) e um dos demais:
○ História familiar de cardiopatia
○ Disfunção sistólica
○ Doenças do sistema de condução
○ Alterações sindrômicas (miopatias, doenças
neuromusculares, Holt-Oram, Síndrome de Barth)
● Familiar de primeiro grau, após estudo genético do probando.
Rendimento do teste genético é 17-40% (dependente do contexto familiar)

PRINCIPAIS GENES RELACIONADOS
| MYH7 | LDB3 |
| MYBPC3 | TBX5 |
| TTN | NKX2-5 |
| ACTC1 | HCN4 |
| RYR2 | TAZ |
| PRDM16 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
●O achado de não-compactação em exame de imagem isoladamente, sem outros critérios clínicos, tem baixo rendimento genético e correlação genótipo-fenótipo incerta.
● Há descrição de maior gravidade em variantes relacionadas à MYH7.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2.Petersen SE, et al. 2005. doi:
10.1016/j.jacc.2005.03.045
3. Clinical Genome Resource
https://clinicalgenome.org.
4. Marcondes-Braga FG, et al. 2021.
Arq Bras Cardiol. 116(6):1174-1212.
Cardiomiopatia Restritiva (CMR)
Cardiomiopatia Restritiva é definida por enchimento ventricular esquerdo (VE)
prejudicado com consequente redução do volume diastólico, e espessura ventricular e
fração de ejeção normais ou próximas do normal. Pode ter causas não-genéticas (Síndrome Carcinoide, Cardiotoxicidade) e genéticas (Amiloidose, Doença de Fabry, Miopatia miofibrilar).
CRITÉRIOS DIAGNÓSTICOS

● Enchimento ventricular prejudicado com
padrão restritivo pelo Ecocardiograma
transtorácico (ECOTT) e Ressonância
Magnética Cardíaca (RMC). Ausência de
dilatação ventricular – ECOTT ou RMC.
● Ausência de hipertrofia – ECOTT ou RMC.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de CMR.
● Familiar de primeiro grau, após estudo genético do probando.
● Pacientes com formas atípicas de apresentação clínica
com suspeita de fenocópia, como em doenças de depósito (Fabry) ou infiltrativas (Amiloidose).
Rendimento do teste genético é 20-60% (dependente do contexto familiar)

PRINCIPAIS GENES RELACIONADOS
| MYH7 | TTR |
| TTN | FLNC |
| ACTC1 | GLA |
| TNNI3 | TNNT2 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
●Detectar possíveis fenocópias que podem ter tratamento específico como, por exemplo, terapia de reposição enzimática na Doença de Fabry, inibidor da síntese hepática ou estabilizador do tetrâmero de TTR na Amiloidose TTR.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2.Kushwaha SS, Fallon JT, Fuster V.
1997. doi: 10.1056/
NEJM199701233360407
3. Clinical Genome Resource
https://clinicalgenome.org.
4. Marcondes-Braga FG, et al. 2021.
Arq Bras Cardiol. 116(6):1174-1212.
Cardiomipatias Congênitas (CC)
As cardiopatias congênitas (CC) são anomalias congênitas de espectro variável e na
maioria das vezes ocorrem de forma isolada em um indivíduo sem outras manifestações
extracardíacas (CC não sindrômicas). Por outro lado, as CC podem ser sindrômicas
quando associadas a manifestações extracardíacas (dismorfismos craniofaciais e
alterações de membros, de crescimento, de desenvolvimento, neurológicas e
genitourinárias). As principais causas genéticas de CC incluem aneuploidias, CNVs (alterações de números de cópias) e condições monogênicas, principalmente quando se trata de CC complexas ou sindrômicas.
CRITÉRIOS PARA AVALIAÇÃO DE PACIENTE
● Indivíduos com CC sindrômicas.
● Indivíduos com CC isoladas e história familiar positiva.
● Indivíduos com CC isoladas que apresentem diagnóstico de:
○ CC complexas
○ Anomalias conotruncais (ex: tetralogia de Fallot, truncus arteriosus, interrupção de arco aórtico tipo B, transposição de grandes artérias, dupla via de saída de VD, dupla via de saída de VE)
○ Defeitos de lateralidade/heterotaxia (ex: situs inversus,
dextrocardia, isomerismo).
● Critérios de exclusão: indivíduos que já tenham sido diagnosticados através de cariótipo ou que apresentem suspeita de aneuploidia.
INDICAÇÃO DO ESTUDO GENÉTICO
● A escolha do método a ser realizado demanda AVALIAÇÃO CLÍNICA com Médico Geneticista.
● Diferentes metodologias de testes podem ser utilizadasde acordo com a suspeita clínica.
● É importante avaliar se há história familiar de cardiopatia e também se houve exposição a teratógenos, diabetes materno e infecções maternas durante o período pré-natal que poderiam causar CC.
Rendimento do teste genético é <50% (variável conforme tipo de exame e doença)

PRINCIPAIS CC E ETIOLOGIA GENÉTICA
Aneuploidias:
Trissomia do 13 (Sd Patau)
Trissomia do 18 (Sd Edwards)
Trissomia do 21 (Sd Down)
Monossomia do X (Sd Turner)
CNVs:
Microdeleção 22q11.2 (Sd DiGeorge)
Microdeleção 7q11.23 (Sd Williams)
Sd Cat eye
Deleção 1p36
Monogênicas:
Sd Adams-Oliver (ARHGAP31, DLL4 ,
NOTCH1, RBPJ, DOCK6, EOGT)
Defeito do Septo Atrial (GATA4, NKX2.5,
TBX5)
Defeito do Septo Atrioventricular (CRELD1,
NR2F2)
Estenose Aórtica Supravalvar (ELN)
Estenose Aórtica Valvar (NOTCH1, TAB2)
Tetralogia de Fallot (NOTCH1, FLT4,
TFAP2B)
Rasopatias (Sd Noonan, Cardio-facio-
cutâneo, NF1)
Sd CHARGE (CHD7, SEMA3E?)
Sd Alagille (JAC1, NOTCH2)
Sd Holt-Oram (TBX5)
Sd Kabuki (KMT2D, KDM6A)
Sd Ivemark (GDF1)
Heterotaxia (ACVR2B, CFC1, NODAL,
CCDC11, CFAP53, PKD1L1, ZIC3)
Sd de Smith-Lemni-Opitz (DHCR7)
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando permitindo manejo clínico específico e aconselhamento genético.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Morton SU, et al. Nat Rev Cardiol. 2022.
doi: 10.1038/s41569-021-00587-4
3. Oxford Desk Reference: Clinical
Genetics and Genomics. Cap2: Congenital
Heart Disease.
4. Saliba A, et al. 2020. J Pediatr (Rio J).
96:279-88.
Fibrilação Atrial Isolada (FA)
Fibrilação Atrial é a arritmia sustentada mais comum na prática clínica e está associada
às principais comorbidades cardiovasculares, como: idade, obesidade, HAS, Diabetes,
Dislipidemia, Tabagismo, Etilismo e outras. A Fibrilação Atrial, quando isolada, pode estar
associada à herança genética primária, às canalopatias, como na SBr1 (Síndrome de Brugada) e SQTC (síndrome de QT curto), pode ser uma forma incipiente de miocardiopatia hereditária, como na LMNA (laminopatia) ou pode estar associada à Doença do Sistema de Condução.
CRITÉRIOS DIAGNÓSTICOS
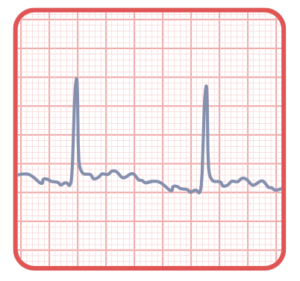
● Diagnóstico clínico de fibrilação atrial isolada: presença de FA em paciente sem cardiopatia estrutural, sem comorbidades e idade < 60 anos.
● Exclusão: hipertireoidismo, uso de drogas (álcool, tabagismo, drogas ilícitas).
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de FA isolada, associada a:
○ história familiar de FA em familiar de 1° grau.
○ implante de marca-passo / CDI por doença do sistema de condução e/ou morte súbita cardíaca abortada.
● Familiar de primeiro grau, após estudo genético do probando.

PRINCIPAIS GENES RELACIONADOS
| SCN5A | TTN |
| KCNQ1 | KCNA5 |
| KCNH2 | GJC1 |
| TBX5 | NPPA |
| GJA5 | LMNA |
| MYL4 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
●Detectar possíveis variantes que podem ter tratamento específico como, por exemplo na LMNA..
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2.Gerhard Hindricks, et al. 2021.
European Heart Journal, 42(5):373.
3. Clinical Genome Resource https://clinicalgenome.org.
4. Magalhães LP, et al. 2016. Arq Bras
Cardiol; 107(1Supl.3):1-58.
5. SOBRAC - Hachul DT, et al. 1a ed. São Paulo: Atheneu, 2020.
Síndrome de Brugada (SBR)
A síndrome de Brugada é uma canalopatia hereditária caracterizado por
supradesnivelamento do segmento ST com morfologia de Brugada tipo 1 (SBr1) nas
derivações precordiais direitas e predisposição à arritmias ventriculares malignas,
podendo estar associado à doença de condução e arritmias atriais. A SBr1 é responsável por cerca de 20% das mortes súbitas inexplicáveis.
CRITÉRIOS DIAGNÓSTICOS
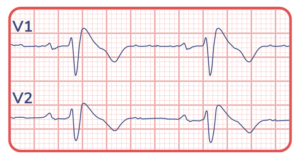
● Supra ST com morfologia de SBr1 de amplitude ≥ 2 mm em pelo menos 1 derivação direita, V1 ou V2 em posição padrão ou em derivações superiores (colocadas no 2o , 3o ou 4o espaços intercostais), sendo espontâneo ou induzido.
● Exclusão: causas secundárias de alteração de ST: isquemia miocárdica, distúrbios eletrolíticos, intoxicações por drogas
ou uso de medicação com efeito bloqueador de canal de sódio.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de Brugada tipo 1 - ECG com padrão de SBr tipo I em derivações precordiais padrão ou derivações superiores, podendo ser espontâneo ou induzido.
● Familiar de primeiro grau, após estudo genético do probando.
Rendimento do teste genético é 20%

PRINCIPAIS GENES RELACIONADOS
| SCN5A | SCN3B |
| CACNA1C | SCN10A |
| CACNB2 | KCNE3 |
| CACNA2D1 | KCNJ8 |
| SCN1B | KCND3 |
| SCNB2 | KCNE3 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Detectar pacientes com variantes patogênicas
associadas a doença de sistema de condução visto que esses pacientes necessitam seguimento clínico individualizado. Variantes raras, como SCN5A E1784K,
podem ter fenótipo misto de síndrome de QT longo tipo 3, doença de sistema de consução e SBr1 e apresentam maior potencial de gravidade.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Clinical Genome Resource https://clinicalgenome.org.
3. Magalhães LP, et al. 2016. Arq Bras
Cardiol; 107(1Supl.3):1-58.
4. SOBRAC - Hachul DT, et al. 1a ed. São Paulo: Atheneu, 2020.
Síndrome do QT Longo (SQTL)
A SQTL congênita é uma canalopatia geneticamente determinada, caracterizada pelo
prolongamento do intervalo QT, na ausência de causas secundárias, geralmente
associado a anormalidades na morfologia da onda T.
CRITÉRIOS DIAGNÓSTICOS
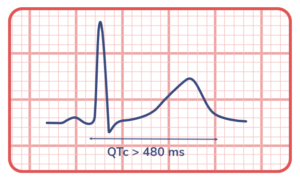
● Score de Schwartz ≥ 3,5.
● Presença de mutação patogênica em genes associados à SQTL. QT corrigido (QTc) ≥ 480 ms em ECGs repetidos.
● QTc 460-479 associado a síncope inexplicada.
○ Excluir causas secundárias de prolongamento do QT como hipocalemia, hipomagnesemia, uso de medicações que
prolongam a repolarização, como alguns antibióticos, antieméticos, etc.
Para maiores informações consulte:
www.crediblemeds.org
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de SQTL.
● Familiar de primeiro grau, após estudo genético do probando.
Rendimento do teste genético é 70%

PRINCIPAIS GENES RELACIONADOS
| KCNQ1 | KCNJ5 |
| KCNH2 | CACNA1C |
| SCN5A | AKAP9 |
| CALM1 | TRDN |
| CALM2 | CAV3 |
| CALM3 | ANK2 |
| KCNJ2 | SCN4B |
| KCNE1 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Identificar pacientes de alto risco arrítmico, de acordo com a variante patogênica encontrada em conjunto com a duração do QTc.
● Estabelecer tratamento gene-guiado: na SQTL1 (gene KCNQ1), por exemplo, o uso de beta bloqueador de ação central é altamente eficaz e simpatectomia pode ser benéfica, enquanto na SQTL3 (gene SCN5A) a medicação mais eficaz é a mexiletina.
● Identitificar variantes raras, como SCN5A E1784K, com fenótipo misto de síndrome de QT longo tipo 3, doença de sistema de condução e SBr1.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Schwartz PJ, Crotti L, Insolia R.
2012. doi: 10.1161/
CIRCEP.111.962019
3. Clinical Genome Resource https://clinicalgenome.org.
4. Magalhães LP, et al. 2016. Arq Bras
Cardiol; 107(1Supl.3):1-58.
5. SOBRAC - Hachul DT, et al. 1a ed. São Paulo: Atheneu, 2020.
Síndrome do QT Curto (SQTC)
A SQTC é uma canalopatia muito rara, caracterizada por um intervalo QT curto no ECG
basal e predisposição à fibrilação atrial e ventricular.
CRITÉRIOS DIAGNÓSTICOS
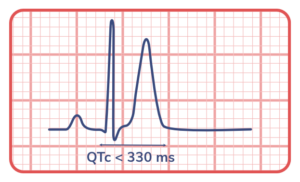
● QT corrigido (QTc) < 330–340 ms.
OU
● QTc entre 340-360 ms associados a um abaixo:
○ variante patogênica em gene associado a SQTC, história familiar de SQTC, Morte Súbita Cardíaca (MSC) abaixo de 40 anos ou sobrevida após um episódio de TV/FV na ausência de doença cardíaca.
○ QTC Score ≥ 4
○ Excluir causas secundárias de encurtamento do QT como
hipercalemia, hipercalcemia, isquemia aguda, uso de drogas ou medicações que possam encurtar a repolarização.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de SQTC.
● História familiar de síncope inexplicada ou MSC.
● Familiar de primeiro grau, após estudo genético do probando.
Rendimento do teste genético é 5-10%

PRINCIPAIS GENES RELACIONADOS
| KCNH2 | KCNJ2 |
| KCNQ1 | SLC4A3 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Clinical Genome Resource https://clinicalgenome.org.
3. Gollob MH, Redpath CJ, Roberts JD.
2011. J Am Coll Cardiol, 57:802–12.
4. Magalhães LP, et al. 2016. Arq Bras
Cardiol; 107(1Supl.3):1-58.
5. SOBRAC - Hachul DT, et al. 1a ed. São Paulo: Atheneu, 2020.
Doença do Sistema de Condução
Doença do Sistema de Condução é uma condição em que ocorre uma disfunção
progressiva do sistema de condução elétrica, heterogênea, idade-dependente,
caracterizada por disfunção na formação ou propagação do impulso elétrico no nodo
sinusal, nodo átrioventricular e fibras de Purkinje.
CRITÉRIOS DIAGNÓSTICOS

● Disfunção do sistema de condução elétrica com
início de apresentação clínica em idade relativamente jovem e sem causa evidente.
● Excluir: cardiopatia estrutural, doença de Chagas, degeneração fibrótica, isquemia, doenças infiltrativas, valvopatias, tumores ou disfunção tireoidiana. Excluir uso de medicações cronotrópicas negativas, como beta bloqueadores, bloqueadores de canais de cálcio e antiarrítmicos.
O ECG pode demonstrar bradicardia sinusal, pausas sinusais, bloqueio sinoatrial, bloqueios atrioventriculares de variados graus e bloqueios de ramo até bloqueio
atrioventricular total.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de doença do sistema de condução sem causa aparente.
● Familiar de primeiro grau, após estudo genético do probando.

PRINCIPAIS GENES RELACIONADOS
| LMNA | PRKAG2 |
| DES | TNNI3K |
| DMD | NKX2-5 |
| DMPK | TBX5 |
| EMD | MYL4 |
| LAMP2 | SCN5A |
| GLA | TRPM4 |
| ZNF9 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Detectar pacientes com variantes patogênicas associadas a risco de desenvolver cardiopatias, como em LMNA e TNNI3K, ou risco de desenvolver Síndrome
de Brugada, como em variantes em SCN5A, para realizar orientações direcionadas específicas.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Clinical Genome Resource https://clinicalgenome.org.
3. Magalhães LP, et al. 2016. Arq Bras
Cardiol; 107(1Supl.3):1-58.
4. SOBRAC - Hachul DT, et al. 1a ed. São Paulo: Atheneu, 2020.
Morte Súbita Cardíaca (MSC)
A morte cardíaca súbita é a morte por causa cardíaca dentro de um curto período de tempo, geralmente 1 hora após o início dos sintomas, em uma pessoa sem qualquer condição prévia. Pode decorrer de causas adquiridas ou genéticas.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com PCR recuperada documentada, se a morte súbita for provavelmente associada a uma doença
cardíaca genética ou se tiver causa inexplicada mesmo após avaliação clínica e toxicológica.
● História familiar de MSC em parentes de primeiro grau, se a morte súbita for provavelmente associada a uma doença cardíaca genética ou se tiver causa inexplicada mesmo após autópsia.

PRINCIPAIS GENES RELACIONADOS
| KCNQ1 | SCN5A |
| KCNH2 | RYR2 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Detectar possíveis etiologias e definir tratamento e seguimento específico, como por exemplo o implante de um CDI.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2. Isbister, J. and Semsarian, C. 2019. doi: 10.1111/imj.14359
3. Clinical Genome Resource https://clinicalgenome.org.
4. Myerburg RJ, Interian A Jr, Mitrani
RM, Kessler KM, Castellanos A. 1997.
doi: 10.1016/s0002-9149(97)00477-3.
5. Magalhães LP, et al. 2016. Arq Bras
Cardiol; 107(1Supl.3):1-58.
6. SOBRAC - Hachul DT, et al. 1a ed. São Paulo: Atheneu, 2020.
Taquicardia Ventricular Polimórfica Catecolaminérgica (TVPC)
É uma arritmia hereditária incomum caracterizada por polimorfismos ventriculares
associados à taquicardia, mediada adrenergicamente (ocorrem durante o exercício ou
estresse emocional).
CRITÉRIOS DIAGNÓSTICOS

● Probando < 40 anos:
○ coração estruturalmente normal + ECG normal + TV bidirecional ou
○ EEVV polimórficas ou
○ TV polimórfica induzida por exercício ou catecolaminas
● Presença de mutação patogênica
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando que satisfaça os critérios diagnósticos para
TVPC ou pontuação no score TVPC > 3,5.
Rendimento do teste genético é 15-60% (dependendo do contexto familiar)

PRINCIPAIS GENES RELACIONADOS
| RYR2 | TRDN |
| CASQ2 | TECRL |
| CALM1-3 | KCNJ2 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Detectar possíveis fenocópias, como por exemplo, Síndrome do QT longo tipo 7.
● Detectar variantes que representam maior gravidade, particularmente o gene RYR2.
Referências
1. Wilde AAM, et al. 2022.
doi: 10.1016/j.hrthm.2022.03.1225
2.Priori, S.G. et al. 2013.
Heart Rhythm 10, 1932-1963.
3. Clinical Genome Resource https://clinicalgenome.org.
4. Giudicessi JR, Lieve KVV, Rohatgi RK,
Koca F, Tester DJ, van der Werf C et al.
2019. Circ Genom Precis Med.
5. Magalhães LP, et al. 2016. Arq Bras
Cardiol; 107(1Supl.3):1-58.
6. SOBRAC - Hachul DT, et al. 1a ed. São Paulo: Atheneu, 2020.
Síndrome de Ehlers-Danlos Vascular (SEDV)
Caracterizada por fragilidade arterial, intestinal e/ou uterina, pele fina e translúcida, dismorfismos faciais, aspecto progeroide das extremidades. Os sinais mais comuns são ruptura ou dissecção vascular e perfuração gastrointestinal.
CRITÉRIOS DIAGNÓSTICOS

● Variante patogênica em heterozigose no gene COL3A1.
● Se análise molecular não for conclusiva, anormalidades na síntese e mobilidade das cadeias de colágeno tipo III em fibroblastos.
INDICAÇÃO DO ESTUDO GENÉTICO
● A SEDv deve ser suspeitada na presença de um dos critérios maiores ou vários critérios menores:
○ Critérios maiores: Aneurismas/dissecções/rupturas arteriais, ruptura intestinal, ruptura uterina durante gestação, história familial positiva para SEDv.
○ Critérios menores: pele fina/translúcida, dismofismos faciais típicos, acrogeria, fístula carótido-cavernosa, hipermobilidade de pequenas articulações, ruptura de tendões/músculos, varizes precoces, hemo/ pneumotórax, fragilidade cutânea, luxações/subluxações articulares crônicas, luxação congênita dos quadris, pés
tortos.
Rendimento do teste genético é >95%

PRINCIPAIS GENES RELACIONADOS
| COL3A1 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando, permitindo manejo clínico específico e prevenção de complicações (relacionadas a traumas, procedimentos invasivos eletivos e
gestação).
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
Referências
1. Byers PH. Vascular Ehlers-Danlos
Syndrome. 1999.
https://www.ncbi.nlm.nih.gov/books/
NBK1494/
2.Drera B, Zoppi N, Ritelli M, Tadini G,
et al. 2011.
doi: 10.1016/j.jdermsci.2011.09.002
3. Coelho SG e Almeida AG. 2016. Rev
Port Cardiol; 39(4):215-226.
Síndrome de Loeys-Dietz (SLD)
A SLD é um importante diagnóstico diferencial de síndrome de Marfan. Pode cursar com alterações vasculares, esqueléticas, dismorfismos craniofaciais, alterações de pele e quadros de inflamação e atopia. Há variabilidade de gravidade tanto inter quanto intrafamilial.
CRITÉRIOS DIAGNÓSTICOS

● Variante patogênica em heterozigose em um dos genes associados à SLD, E
● 1. Dilatação de raiz aórtica (z ≥2.0) ou
● 2. Dissecção tipo A ou
● 3. Achados sistêmicos:
○ Vasculares: tortuosidades arteriais (principalmente cranio-
cervicais), aneurismas e dissecções.
○ Dismorfismos craniofaciais: hipertelorismo ocular, estrabismo, úvula bífida, fenda palatina, craniossinostose.
○ Esqueléticos: pectus excavatum ou carinatum, escoliose,
hipermobilidade articular, aracnodactilia, pé torto, alterações cervicais.
○ Dermatológicas: pele aveludada, translucente, fragilidade capilar,
cicatrizes distróficas.
○ Alergo-Imunológicas: alergias alimentares, alergias sazonais,
asma, eczema, esofagite eosinofílica, doença inflamatória intestinal.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo de SLD (baseado em história
clínica, exame físico, exames)
Obs.: Indivíduos com SLD podem ter escore sistêmico para síndrome de Marfan ≥7 pontos

PRINCIPAIS GENES RELACIONADOS
| TGFBR2 | TGFB2 |
| TGFBR1 | SMAD3 |
| TGFB3 | SMAD2 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando, permitindo manejo clínico específico.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Diferenciar de outras síndromes genéticas com sobreposição clínica como síndromes de Marfan, Shprintzen-Goldberg, Ehlers-Danlos, síndrome das artérias tortuosas, que podem
ter outros padrões de herança modificando o
aconselhamento genético.
Referências
1. Loeys BL, Dietz HC. Loeys-Dietz
Syndrome. 2008.
www.ncbi.nlm.nih.gov/books/
NBK1133/
2. H. Nejadhamzeeigilani, T. Buende
Tchokouako, et al. 2017. doi: doi.org/10.1594/ecr2017/C-2415.
3. Coelho SG e Almeida AG. 2016. Rev
Port Cardiol; 39(4):215-226.
4. Graffunder FP, et al.2017. Int J
Cardiovasc Sci; 30(2).

Faça aqui o download do cartaz em PDF!
Síndrome de Marfan (SM)
Doença sistêmica do tecido conjuntivo que apresenta expressividade variável e penetrância alta. O sistema cardiovascular, esquelético e olhos são os principais afetados. Os pacientes geralmente apresentam hábito marfanoide com dolicostenomelia (índice envergadura/estatura >1,05), e aspecto longilíneo.
CRITÉRIOS DIAGNÓSTICOS
Na ausência de história familiar:
● Dilatação da raiz da aorta (Z-score ≥2) E ectopia lentis.
● Dilatação da raiz da aorta (Z-score ≥2) E Escore Sistêmico ≥ 7 pontos Escore Sistêmico de Marfan
● Presença de variante patogênica em heterozigose no gene FBN1 já descrita em SM, associada a ectopia lentis ou dilatação da aorta.
Obs.: as manifestações da SM podem surgir na vida adulta, logo, indivíduos com menos de 20 anos que não preenchem critérios clínicos devem ser reavaliados posteriormente.
INDICAÇÃO DO ESTUDO GENÉTICO
● Indivíduos com um dos seguintes achados e/ou história familiar compatível com herança autossômica dominante:
○ Dilatação da raiz da aorta (Z-score ≥2 para idade e peso).
○ Ectopia lentis (subluxação do cristalino), vista em exame oftalmológico com lâmpada de fenda após dilatação da pupila.
○ Escore sistêmico ≥7 pontos.
Rendimento do teste genético > 90% (em indivíduos com fenótipo de SM clássica)

PRINCIPAIS GENES RELACIONADOS
| FBN1 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando, permitindo manejo clínico específico.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Diferenciar de outras síndromes genéticas que podem levar a um escore positivo (≥7) como síndromes de Loeys-Dietz, Shprintzen-Goldberg, Ehlers-Danlos e homocistinúria.
Referências
1. Dietz H. FBN1-Related Marfan
Syndrome. 2001
www.ncbi.nlm.nih.gov/books/
NBK1355/
2. The Marfan Foundation website
https://marfan.org/dx/score/
3. Loeys BL, Dietz HC, et Al. 2010.
doi: 10.1136/jmg.2009.072785
4. Coelho SG e Almeida AG. 2016. Rev
Port Cardiol; 39(4):215-226.
5. Graffunder FP, et al.2017. Int J
Cardiovasc Sci; 30(2).
Aneurisma e Dissecção de Aorta Torácica (AAT e DAT)
AAT representa dilatação da aorta torácica com aumento de pelo menos 50% do seu diâmetro. DAT é uma lesão na parede da aorta torácica com separação entre as camadas íntima e média e consequente formação de uma luz falsa.
CRITÉRIOS DIAGNÓSTICOS

● AAT: aumento de 50% de diâmetro da aorta em relação ao esperado em exame de imagem.
● DAT: presença de flap separando falsa luz da luz verdadeira em exame de imagem.
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com AAT OU DAT (atual ou prévio) E
● Características fenotípicas sindrômicas OU história familiar positiva para doença de aorta torácica OU idade < 56 anos

PRINCIPAIS GENES RELACIONADOS
| TGFB2 | TGFBR2 |
| MYH11 | TGFBR1 |
| SMAD3 | PRKG1 |
| FBN1 | MYLK |
| ACTA2 | LOX |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando.
● Rastrear e aconselhar familiares para diagnóstico precoce da doença.
● Diferenciar de outras síndromes genéticas que podem levar a um escore positivo (≥7) como síndromes de Loeys-Dietz, Shprintzen-Goldberg, Ehlers-Danlos e homocistinúria. Detectar possíveis variantes que influenciarão pior prognóstico ou indicação cirúrgica precoce.
Referências
1.2014 ESC Guidelines on the
diagnosis and treatment of aortic.
doi: 10.1093/eurheartj/ehu281
2. Pinard A, Jones GT, Milewicz DM.
2019.
doi: 10.1161/circresaha.118.312436
3. Clinical Genome Ressource
https://clinicalgenome.org
4. Saeyeldin, A.A., et al. 2019. Gen
Thorac Cardiovasc Surg 67, 1–11.
5. Nienaber, C., Clough, R. et al. 2016.
doi: 10.1038/nrdp.2016.53.
6. Coelho SG e Almeida AG. 2016. Rev
Port Cardiol; 39(4):215-226.
7. Graffunder FP, et al.2017. Int J
Cardiovasc Sci; 30(2).
Hipercolesterolemia Familiar (HC)
Hipercolesterolemia Familiar (HF) é uma causa genética de elevação do LDL-c e consequente aumento no risco de doença coronariana prematura, especialmente de infarto do miocárdio, devido à exposição prolongada a concentrações elevadas dessa lipoproteína ao longo da vida.
CRITÉRIOS DIAGNÓSTICOS

● No Brasil o critério diagnóstico mais utilizado é o Dutch MEDPED, que segue uma escala de pontuação:
○ > 8 pontos: Definitivo
○ > 6 a 8 pontos: Provável
○ > 3 a 5 pontos: Possível
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando (caso índice) com suspeita clínica de HF, descartadas causas secundárias (exemplo: hipotireoidismo descontrolado, síndrome nefrótica, doença colestática, uso de medicações que aumentam colesterol, etc) e níveis de colesterol sem tratamento prévio correspondentes a:
○ Adultos com LDL > 230 mg/dL5 ou
○ Adultos com LDL > 210 mg/dL com histórico familiar ou pessoal de DAC precoce ou
○ Adultos com LDL>210mg/dL com histórico familiar de hipercolesterolemia (familiar de primeiro grau com LDL>190mg/dL)
○ Crianças com idade 160mg/dL

PRINCIPAIS GENES RELACIONADOS
| LDLR | PCSK9 |
| APOB | LDLRAP1 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando (caso índice).
● Os riscos de detecção de variante genética patogênica para parentes e as implicações para o planejamento familiar diferem entre esses cenários.
Referências
1.Schmidt EB, et al. 2020.
doi: 10.1136/heartjnl-2019-316276
2. Izar MCO, Giraldez VZR, et al. 2021.
Arq. Bras. Cardiol. 2021. 117:
782-844.
3. Mach F, et al. 2019.
doi: 10.1093/eurheartj/ehz455
4. Clinical Genome Ressource
https://clinicalgenome.org
5. Silva PRS et al. 2017. 263:257-262

Faça aqui o download do cartaz em PDF!
Sitosterolemia (ST)
A sitosterolemia é uma doença rara, autossômica recessiva. É caracterizada por níveis séricos elevados de esteróis vegetais especialmente sitosterol, campesterol e estigmasterol. O quadro clínico inclui a apresentação de xantomas, xantelasmas, alterações hematológicas e doença
cardiovascular aterosclerótica (DAC) precoce. A dieta rica em vegetais influencia diretamente como um agravante para a doença. O tratamento com estatinas é insuficiente e apresenta uma resposta melhor ao uso de ezetimiba.
CRITÉRIOS DIAGNÓSTICOS

● Xantomas: depósitos de gordura que podem estar localizados em regiões como calcanhares, joelhos, cotovelos, mãos, entre outros.
● Xantelasmas: depósito de gordura na região das pálpebras.
● Alterações hematológicas: plaquetopenia, anemia e presença de estomatócitos.
● DAC precoce (homens < 55 anos e mulheres < 60 anos). Resposta adequada ao tratamento com ezetimibe.
● Níveis de beta-sitosterol ≥ 15μg/mL.
INDICAÇÃO DO ESTUDO GENÉTICO
● Faz parte do diagnóstico diferencial da hipercolesterolemia familiar (HF), logo, é indicado para indivíduos com fenótipo de HF com alterações hematológicas (principalmente plaquetopenia) ou resposta adequada ao tratamento com ezetimiba.

PRINCIPAIS GENES RELACIONADOS
| ABCG5 | ABCG8 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando (caso índice).
● Rastreamento familiar para averiguação de novos afetados e aconselhamento familiar.
● Melhor orientação para tratamento da doença, como dieta e uso de hipolipemiantes adequados.
● Identificação precoce da doença evitando eventos como DAC prematura.
Referências
1. Buonuomo PS, Iughetti L, et al.
2017. 262:71–77.
2. Escolà-Gil JC, Quesada H, et al.
2014. Curr Atheroscler Rep. 16.
3. Myrie S, Roullet J-B, Sitosterolemia
Foundation. Sitosterolemia [Internet ].
Nation Organ. Rare Disord. 2019;1–8.
4. Clinical Genome Ressource
https://clinicalgenome.org

Faça aqui o download do cartaz em PDF!
Rasopatias (RAS)
As RASopatias são um grupo de síndromes genéticas causadas por alterações germinativas em genes que codificam componentes de reguladores da via RAS/MAPK.
CRITÉRIOS DIAGNÓSTICOS

● Dismorfismos típicos: hipertelorismo ocular, ptose palpebral, fendas palpebrais oblíquas para baixo, pescoço curto e/ou alado, alteração de pectus (em S, carinatum ou
excavatum), hipertelorismo mamilar, criptorquidia.
● Baixa estatura
● Cardiopatia congênita, mais comumente estenose valvar pulmonar, comunicação interatrial (CIA) e/ou miocardiopatia hipertrófica.
● Atraso do desenvolvimento de grau variável
● Displasia linfática dos pulmões, intestinos e/ou membros inferiores
● Problemas de coagulação
● História familiar sugestiva
● Para NF1: manchas café-com-leite, efélides axilares /inguinais, neurofibromas, tumores.
● Para síndrome de Legius: manchas café-com-leite, efélides axilares / inguinais
INDICAÇÃO DO ESTUDO GENÉTICO
● Probando com fenótipo sugestivo de síndrome de
Noonan e síndromes correlatas (RASopatias).
Rendimento do teste genético é ~70%
(depende do tipo de coorte analisada)

PRINCIPAIS GENES RELACIONADOS
| BRAF | SOS1 |
| KRAS | SOS2 |
| MAP2K1 | LZTR1 |
| MRAS | MAPK1 |
| NRAS | HRAS |
| PTPN11 | SHOC2 |
| RAF1 | PPP1CB |
| RASA2 | NF1 |
| RIT1 | SPRED1 |
| RRAS2 |
IMPLICAÇÕES CLÍNICAS DO TESTE GENÉTICO
● Confirmar um diagnóstico no probando (caso índice).
● Rastrear e aconselhar familiares para diagnóstico precoce da doença. Orientar manejo adequado.
Referências
1. Roberts AE. Noonan Syndrome. 2001
https://www.ncbi.nlm.nih.gov/books/
NBK1124/?report=classic
2. Digilio, M. & Lepri, Francesca & Dentici,
et al. 2011. doi: 10.1159/000331266
3. https://omim.org/entry/163950
4. Malaquias AC, et al. Arq Bras
Endocrinol Metab 2008; 52(5)
5. Sousa VC, et al. J Port Soc Dermat
2017; 75(1):9-18.
















